
技术原理
aqMan探针法核心是探针分子,TaqMan探针是单链DNA,5’端偶联发光基团,3’端偶联淬灭基团,游离的完整探针是检测不到荧光信号的,发光基团发出的荧光会被淬灭基团吸收淬灭,探针被水解,发光基团和淬灭基团远离就可以检测到荧光信号。反应开始时,模板链经热变性解链形成单链,TaqMan探针优先跟模板链退火,引物随后退火到模板上,之后进行链的延伸,延伸过程中Taq酶发挥5’-3’外切酶活性,遇到探针会从5’端逐个碱基切除探针,发光基团会跟淬灭基团分开,因此荧光检测系统可以接收到荧光信号,每扩增一条DNA链,就有一个荧光分子形成,荧光信号的累积和PCR产物形成是同步的。
TaqMan探针法的特异性除了由引物提供,更由探针分子保证,因其退火温度更高,所以TaqMan探针法特异性更好,在一个反应体系中加入多条探针,可以做多个基因同时检测。
实验方法原理
实时荧光定量PCR技术,是指在PCR反应体系中加入荧光基团,利用荧光信号积累实时监测整个PCR进程,最后通过标准曲线对未知模板进行定量分析的方法。
实时荧光定量PCR技术是指在PCR反应体系中加入可与DNA产物特异性结合的荧光基团,利用荧光信号积累实时监测整个PCR进程,最终通过相对定量或绝对定量的方法确定各个样本的本底表达量。qPCR检测常用的两种方法:染料法和TaqMan探针法。
1.SYBRGreenⅠ法:
在PCR反应体系中,加入过量SYBR荧光染料,SYBR荧光染料特异性地掺入DNA双链后,发射荧光信号,而不掺入链中的SYBR染料分子不会发射任何荧光信号,从而保证荧光信号的增加与PCR产物的增加完全同步。
2.TaqMan探针法:
探针完整时,报告基团发射的荧光信号被淬灭基团吸收;PCR扩增时,Taq酶的5’-3’外切酶活性将探针酶切降解,使报告荧光基团和淬灭荧光基团分离,从而荧光监测系统可接收到荧光信号,即每扩增一条DNA链,就有一个荧光分子形成,实现了荧光信号的累积与PCR产物的形成完全同步。
相关应用
1.临床疾病诊断
各型肝炎、艾滋病、禽流感、结核、性病等传染病诊断和疗效评价;地中海贫血、血友病、性别发育异常、智力低下综合症、胎儿畸形等优生优育检测;肿瘤标志物及瘤基因检测实现肿瘤病诊断;遗传基因检测实现遗传病诊断。
禽流感、新城疫、口蹄疫、猪瘟、沙门菌、大肠埃希菌、胸膜肺炎放线杆菌、寄生虫病等、炭疽芽孢杆菌。
食源微生物、食品过敏源、转基因、乳品企业阪崎肠杆菌等检测。
医学、农牧、生物相关分子生物学定量研究。
各级各类医疗机构、大学及研究所、CDC、检验检疫局、兽医站、食品企业及乳品厂等。
由于qPCR是实时定量检测致病病原体基因核酸,因此它比化学发光、时间分辨、蛋白芯片等免疫学方法更具独到优势。

五、案例展示
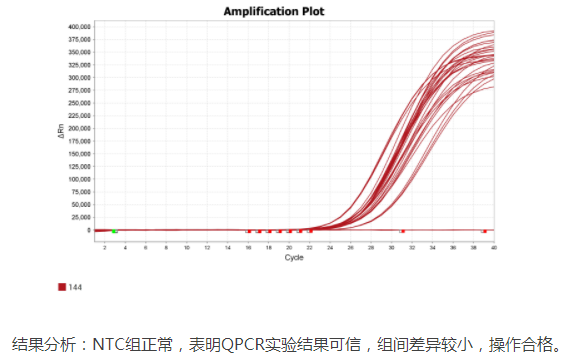
六、 常见问题
1) 引物设计
1、序列选取应在基因的保守区段;
2、Taqman探针技术要求片段长度在50bp-150bp;
3、避免引物自身形成环状发卡结构。避免引物自身或与引物之间形成4个或4个以上连续配对;
4、典型的引物18到24个核苷长。引物需要足够长,保证序列独特性,并降低序列存在于非目的序列位点的可能性。但是长度大于24核苷的引物并不意味着更高的特异性,较长的序列可能会与错误配对序列杂交,降低了特异性,而且比短序列杂交慢,从而降低了产量。Tm值在55-65℃,GC含量在40%-60%;
5、引物之间的Tm值相差避免超过2°C;
6、引物的3’端避免出现3个或3个以上连续相同的碱基;
7、为避免基因组的扩增,引物设计最好能跨两个外显子;
8、探针位置尽可能地靠近上游引物;
9、探针的5'端应避免使用碱基G,引物的3’端避免使用碱基A。探针长度通常在25~35bp,Tm值在65~70°C ,通常比引物Tm高5 ~10°C,GC含量在40%~ 70%;
10、整条探针中,碱基C的含量要明显高于G的含量;
11、为确保引物探针的特异性,最好将设计好的序列在Blast中核实一次,如果发现有非特异性互补区,建议重新设计引物探针。
2) 热启动
热启动PCR是除了好的引物设计之外,提高PCR特异性最重要的方法之一。
3) 镁离子浓度
镁离子影响PCR的多个方面,如:对DNA聚合酶的活性的影响进而影响产量;对引物退火的影响,进而影响特异性。若dNTP和模板同镁离子结合,则降低了酶活性所需要的游离镇离子的量。
4) 模板质量
模板的质量会影响产量。DNA样品中可能有多种污染物会抑制PCR。
5) 防止残余污染
1、PCR易受污染的影响,因为它是一种敏感的扩增技术。小量的外源DNA污染可以与目的模板一块被扩增。当前一次扩增产物用来进行新的扩增反应时,会发生共同来源的污染。这称之为残余污染。从其它样品中纯化的DNA或克隆的DNA也会是污染源(非残余污染)。
2、可以在PCR过程中使用良好的实验步骤减少残余污染。为PCR样品配制和扩增后分析设计隔离的区域,在准备新反应前更换手套。总是使用不含有模板的阴性对照检测污染。使用预先混合的反应成份,而不是每个反应的每个试剂单独加入。
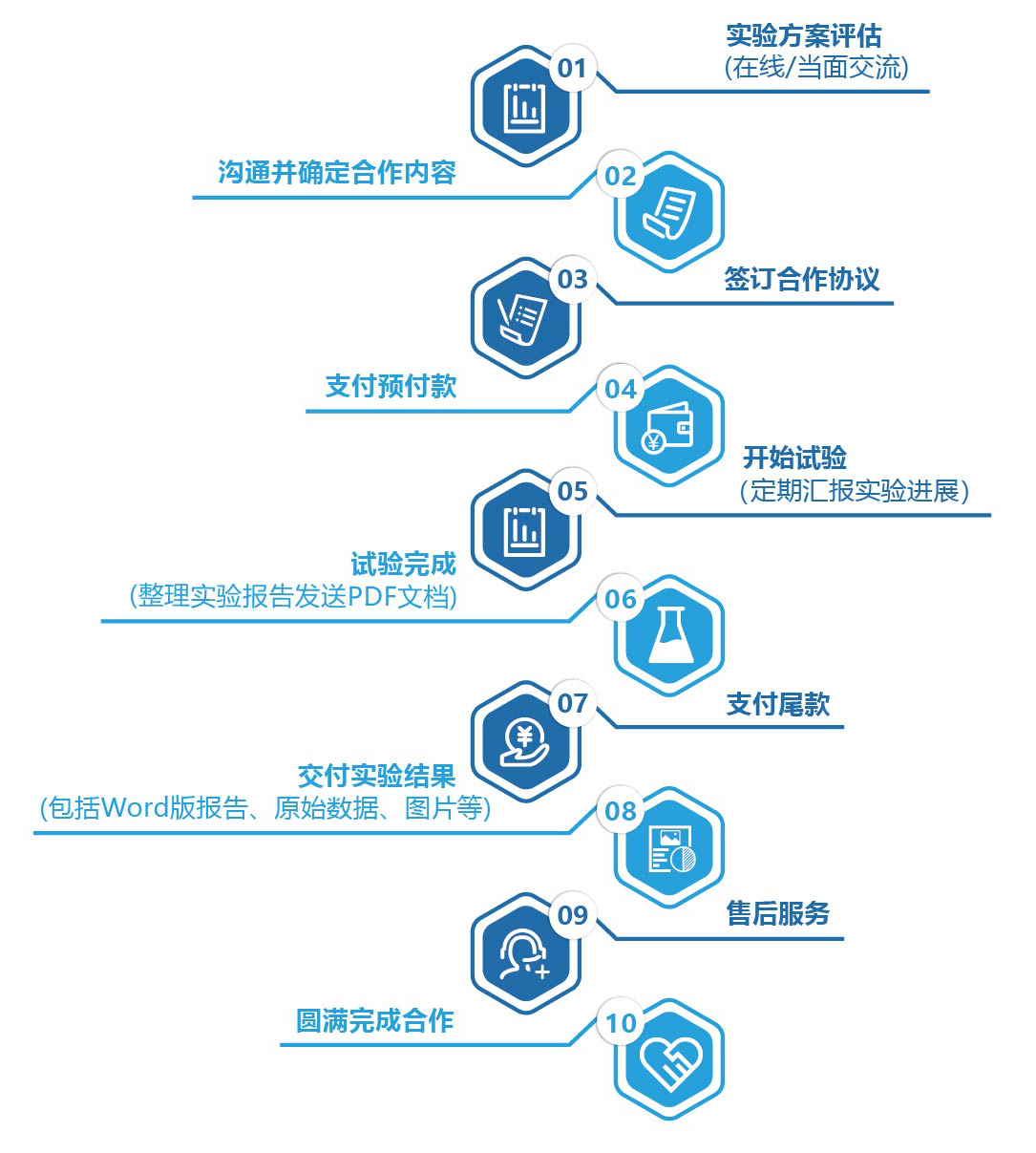
七、服务流程
病理学检测
分子生物学检测
免疫学检测服务
细胞实验服务
动物实验平台